
欧洲补充保护证书介绍与实践
1993年1月2日,欧盟的药品补充保护证书(concerning
the supplementary protection certificate for medicinal
products)正式生效,该制度旨在补偿药品专利权人在寻求上市行政许可中损失的专利保护期而实施的延长保护期的制度,目的在于确保药品开发商收回研发投资并实现利益最大化。2020年10月17日,十三届全国人大常委会第二十二次会议表决通过了关于修改专利法的决定,修改后的专利法增加了新药补偿制度,此举将会对我国药品市场起到巨大影响。
10月29日,“知产前沿”线上直播特别邀请到卡洛知识产权服务集团专利律师罗颖坤律师,结合其30余年相关工作经历,对欧洲药品补充保护证书制度做详细介绍并针对重点实践问题进行解答。以下为本次直播内容文字整理,以飨读者。

罗颖坤律师从1988年到1999年分别任中国烟台师范学院讲师、河北师范大学讲师、慕尼黑大学生物系植物研究所研究员,之后又在多家海外知识产权律所担任专利工程师和专利律师,拥有精湛缜密的专业理论知识同时具备丰富的实践操作经验。
SPC的定义及范畴
要把我SPC的定义,需要准确掌握以下几个概念:
1) “medical product/医药产品”指为治疗或预防人类或动物疾病而存在的任何物质或物质组合,以及为进行医学诊断或恢复、纠正或改变人类或动物生理功
能而给人类或动物服用的任何物质或物质组合;
2) “product/产品”指医疗产品的有效成分或有效成分的混合物;
3) “basic patent/基础专利”是指保护产品本身、获得产品的过程或产品的应用的专利,专利持有人可以以此为基础申请补充保护证书;
申请SPC需要满足两个条件,一是相关药品要具有专利保护,二是相关产品需要有欧盟的药品市场许可。
1) 产品受到一个有效的基本专利的保护;
2) 根据欧盟Directive 2001/83/EC or Directive 2001/82/EC 指令颁布的药品上市许可;
3) 该产品未曾申请过保护证书;
4) 2)中提到的上市许可是第一个上市许可;
简而言之,获得SPC的条件是:一个基础专利的存在、一個有效的药品市场許可、该产品以前沒有被授予过SPC、药品市场许可证是第一次的许可证。
所以SPC并不是简单的专利保护期的延长,因为通常的情况下权利人更倾向于要求专利保护的范围更大,SPC的保护范围只局限于有上市许可的药品,而且只适用于特定的医疗用途,例如某一款药是用于治疗乳腺癌的,则SPC保护的范围仅在乳腺癌的应用方面。
另外,罗颖坤博士还特意提到,除欧盟28个成员国外,瑞士、挪威、冰岛三个国家也可以申请SPC。
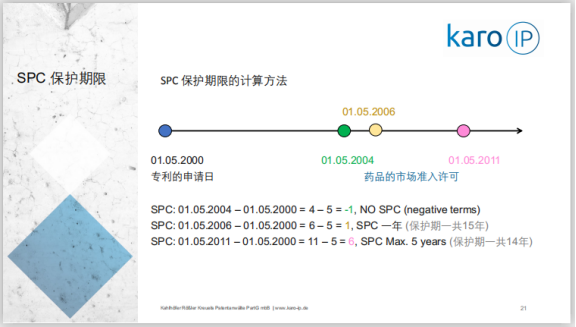
1)保护证书在基本专利失效的时候生效,证书的期限是基本专利的申请日和颁发药品上市许可的日期之间的时间差距再减掉5年的期限
2)无论第一条的结果如何,保护证书的最长期限不应该超过5年
3)在满足Article 36 of Regulation (EC) No 1901/2006规定的情况下,第1和第2条规定的保护期限可以延长6个月,延长只能有一次
其中,Article 36 of Regulation (EC) No 1901/2006的内容是:
如果根据第7条或第8条提出的申请包括了按照规定的儿科用药研究计划进行的
所有研究的结果,则专利或补充保护证书的持有人有权将(欧共体)第1768/92号
条例第13条第(1)款和第13条第(2)款所述的期限延长6个月。
如果规定的儿科用药研究计划的完成未能导致儿科适应症的授权,但所进行的研
究结果体现在产品特性摘要文件中,或者在合适的情况下,体现在有关医药产品
的包装单上,则第一项也应适用。
罗颖坤博士在直播中对上述规定通过举例等方式进行了详细地讲解,SPC保护期限的计算方法示例图如下:
“… .一种本身不具有任何治疗作用的物质,用于获得某种药物形式的医药产品,
不属于 "活性成分 "概念的范围,而 "活性成分 "又用于界定 "产品 "一词”。
后来欧盟法院又通过不同大的案例判决显示出其对于产品/医疗产品的定义:
a)是一种通过药理学、免疫学或新陈代谢手段在人体内发挥主要预期作用的产品
(C-631/13);
b) 是指活性药物成分本身或活性成分的组合,和用于哪种疾病的治疗,是用于人
或动物治疗、以制剂或原药形式存在没有关系(C-205/05) ;
C) 不包括含有辅助药物物质的医疗器械 (C-527/17);
d) 不包括没有活性功能的辅剂(C-210/13)。
SPC可以基于保护产品本身的专利和保护产品的生产方法的专利以及保护产品的应用的专利。
需要注意的是,在提交SPC申请时,该专利必须在申请SPC的国家有效,该专利可以直接从国家专利局或欧洲专利局(EPO)获得。另外如果有一项以上的相关利,专利权人可以自由选择SPC所依据的专利。
基本专利的保护范围
1)作为SPC主体的产品在权利要求书中应当被明确提及;
2)在专利的权利要求中,该活性成分可以通过功能式来识别;结构式不是必须的;
3)对组合物专利来说,组合物必须属于专利保护的范围,组合物中的每一种活性成分都需在专利中有披露;
4)活性成分及其所有衍生物都受到基础专利保护;
5)由生产方法定义的产品的权利要求。
欧盟法院的判例具有指导性作用,因此,在这一部分罗颖坤博士着重介绍了四个具有代表性的判例,具体内容可以在知产前沿微信公众号的知产在线板块收看回放。在涉及组合产品的案件中,一般有两种不同的方法,一类是披露标准(在一些成员国也称为 “明确指出 "或 "主题事项 "检验),一类是侵权性测试。披露标准可以理解为逐字逐句对应权利要求中有文字记叙的内容,侵权性措施则关注相关产品有没有落入我方专利保护范围。
例如,SPC指令当中规定上市许可是在欧盟国家境内的许可,但是前面也说到SPC也可以在瑞士、挪威和冰岛等国家申请。由此带来一个问题,在瑞士、挪威、冰岛三个国家的上市许可算不算SPC指令当中提到的被认可的上市许可,尤其是瑞士,众所周知瑞士是国际上一个很重要的制药大国。关于这一问题,从近些年欧盟的法院判决可以看出,瑞士的上市许可符合SPC指令规定的欧盟国家上市许可。原因之一是,在瑞士上市的药品会根据瑞士跟列支敦士登之间的协议从而使得该药品同样可以在列支敦士登也获得上市许可。这是关于“第一次许可”的第一个大的争议点。
在SPC中最具争论的条款这一板块分享的最后,罗颖坤博士列举了大量的经典案例并做以细致解读,例如赛诺菲的上市许可、泰尔米沙坦联合氢氯噻嗪的上市许可等等。
中国2020年的专利法修改中增加了新药补偿制度,虽然关于这一制度在法条中没有做出详细规定,只有概括性指导:为补偿新药上市审评审批占用的时间,对在中国获得上市许可的新药相关发明专利,国务院专利行政部门应专利权人的请求给予专利权期限补偿。补偿期限不超过五年,新药批准上市后总有效专利权期限不超过十四年。
罗颖坤博士认为中国新药补偿制度具体的细节性的规定非常值得期待,比如在中国的新药补偿制度中如何定义新药、如何定义专利权、以及一个专利多于一个新药的情况下如何补偿等等问题,罗颖坤博士看好国内药品市场的发展,也指出接下来会有越来越多的经验和案例,值得从业人员关注。


10月29日,“知产前沿”线上直播特别邀请到卡洛知识产权服务集团专利律师罗颖坤律师,结合其30余年相关工作经历,对欧洲药品补充保护证书制度做详细介绍并针对重点实践问题进行解答。以下为本次直播内容文字整理,以飨读者。

拥有欧洲专利局专利授予程序方面的经验,特别是在处理审查意见通知书和异议程序方面,拥有欧洲专利局申诉程序方面的经验,在专利侵权程序、专利有效性专家鉴定以及专利保护范围、专家鉴定自由使用权、许可证事务咨询方面也富有经验,对中国专利制度有全面深度了解,技术重点专长是生命科学和医药领域,特别是基因技术、生物化学、分子生物学、基因治疗、细胞生物学、免疫学、病毒学、药学、制药学和有机化学、DNA阵列、医疗器械、化学工程以及化学工艺方面。
关注“知产前沿”公众号,回复“SPC”获取本期线上直播分享课件。一、关于SPC的概述
要把我SPC的定义,需要准确掌握以下几个概念:
1) “medical product/医药产品”指为治疗或预防人类或动物疾病而存在的任何物质或物质组合,以及为进行医学诊断或恢复、纠正或改变人类或动物生理功
能而给人类或动物服用的任何物质或物质组合;
2) “product/产品”指医疗产品的有效成分或有效成分的混合物;
3) “basic patent/基础专利”是指保护产品本身、获得产品的过程或产品的应用的专利,专利持有人可以以此为基础申请补充保护证书;
申请SPC需要满足两个条件,一是相关药品要具有专利保护,二是相关产品需要有欧盟的药品市场许可。
获得SPC证书的条件
在提交申请的成员国内,如果在申请提交之日满足下列条件,则应授予保护证书:1) 产品受到一个有效的基本专利的保护;
2) 根据欧盟Directive 2001/83/EC or Directive 2001/82/EC 指令颁布的药品上市许可;
3) 该产品未曾申请过保护证书;
4) 2)中提到的上市许可是第一个上市许可;
简而言之,获得SPC的条件是:一个基础专利的存在、一個有效的药品市场許可、该产品以前沒有被授予过SPC、药品市场许可证是第一次的许可证。
受保护的主体
关于受保护的主体,相关法律规定“在基础专利的保护范围之內,並且SPC的保护范围局限於获得市场許可的产品,用於被许可的医疗用途。”所以SPC并不是简单的专利保护期的延长,因为通常的情况下权利人更倾向于要求专利保护的范围更大,SPC的保护范围只局限于有上市许可的药品,而且只适用于特定的医疗用途,例如某一款药是用于治疗乳腺癌的,则SPC保护的范围仅在乳腺癌的应用方面。
另外,罗颖坤博士还特意提到,除欧盟28个成员国外,瑞士、挪威、冰岛三个国家也可以申请SPC。
SPC 保护期限
关于SPC 保护期限,相关法律规定:1)保护证书在基本专利失效的时候生效,证书的期限是基本专利的申请日和颁发药品上市许可的日期之间的时间差距再减掉5年的期限
2)无论第一条的结果如何,保护证书的最长期限不应该超过5年
3)在满足Article 36 of Regulation (EC) No 1901/2006规定的情况下,第1和第2条规定的保护期限可以延长6个月,延长只能有一次
其中,Article 36 of Regulation (EC) No 1901/2006的内容是:
如果根据第7条或第8条提出的申请包括了按照规定的儿科用药研究计划进行的
所有研究的结果,则专利或补充保护证书的持有人有权将(欧共体)第1768/92号
条例第13条第(1)款和第13条第(2)款所述的期限延长6个月。
如果规定的儿科用药研究计划的完成未能导致儿科适应症的授权,但所进行的研
究结果体现在产品特性摘要文件中,或者在合适的情况下,体现在有关医药产品
的包装单上,则第一项也应适用。
罗颖坤博士在直播中对上述规定通过举例等方式进行了详细地讲解,SPC保护期限的计算方法示例图如下:

二、SPC中最具争论的条款
在过去27年里,SPC制度里最具争议点主要集中于从专利的角度,从上市许可的角度来看,什么是“产品?什么是“基本专利”?什么是“第一次许可”?这三点,甚至常常引起法律诉讼。产品/医疗产品的定义
欧盟指令曾在相关文件中提及关于“产品”的定义:“… .一种本身不具有任何治疗作用的物质,用于获得某种药物形式的医药产品,
不属于 "活性成分 "概念的范围,而 "活性成分 "又用于界定 "产品 "一词”。
后来欧盟法院又通过不同大的案例判决显示出其对于产品/医疗产品的定义:
a)是一种通过药理学、免疫学或新陈代谢手段在人体内发挥主要预期作用的产品
(C-631/13);
b) 是指活性药物成分本身或活性成分的组合,和用于哪种疾病的治疗,是用于人
或动物治疗、以制剂或原药形式存在没有关系(C-205/05) ;
C) 不包括含有辅助药物物质的医疗器械 (C-527/17);
d) 不包括没有活性功能的辅剂(C-210/13)。
关于基本专利
SPC必须基于什么类型的专利?SPC可以基于保护产品本身的专利和保护产品的生产方法的专利以及保护产品的应用的专利。
需要注意的是,在提交SPC申请时,该专利必须在申请SPC的国家有效,该专利可以直接从国家专利局或欧洲专利局(EPO)获得。另外如果有一项以上的相关利,专利权人可以自由选择SPC所依据的专利。
基本专利的保护范围
1)作为SPC主体的产品在权利要求书中应当被明确提及;
2)在专利的权利要求中,该活性成分可以通过功能式来识别;结构式不是必须的;
3)对组合物专利来说,组合物必须属于专利保护的范围,组合物中的每一种活性成分都需在专利中有披露;
4)活性成分及其所有衍生物都受到基础专利保护;
5)由生产方法定义的产品的权利要求。
欧盟法院的判例具有指导性作用,因此,在这一部分罗颖坤博士着重介绍了四个具有代表性的判例,具体内容可以在知产前沿微信公众号的知产在线板块收看回放。在涉及组合产品的案件中,一般有两种不同的方法,一类是披露标准(在一些成员国也称为 “明确指出 "或 "主题事项 "检验),一类是侵权性测试。披露标准可以理解为逐字逐句对应权利要求中有文字记叙的内容,侵权性措施则关注相关产品有没有落入我方专利保护范围。
关于“第一次许可”
在SPC制度刚刚生效的时候,关于什么是第一次市场许可的争议非常多,因为彼时欧盟国家之间没有统一的标准来判断是否对某个药品进行批准上市。例如,SPC指令当中规定上市许可是在欧盟国家境内的许可,但是前面也说到SPC也可以在瑞士、挪威和冰岛等国家申请。由此带来一个问题,在瑞士、挪威、冰岛三个国家的上市许可算不算SPC指令当中提到的被认可的上市许可,尤其是瑞士,众所周知瑞士是国际上一个很重要的制药大国。关于这一问题,从近些年欧盟的法院判决可以看出,瑞士的上市许可符合SPC指令规定的欧盟国家上市许可。原因之一是,在瑞士上市的药品会根据瑞士跟列支敦士登之间的协议从而使得该药品同样可以在列支敦士登也获得上市许可。这是关于“第一次许可”的第一个大的争议点。
在SPC中最具争论的条款这一板块分享的最后,罗颖坤博士列举了大量的经典案例并做以细致解读,例如赛诺菲的上市许可、泰尔米沙坦联合氢氯噻嗪的上市许可等等。
三、对中国新药补偿制度的展望
中国2020年的专利法修改中增加了新药补偿制度,虽然关于这一制度在法条中没有做出详细规定,只有概括性指导:为补偿新药上市审评审批占用的时间,对在中国获得上市许可的新药相关发明专利,国务院专利行政部门应专利权人的请求给予专利权期限补偿。补偿期限不超过五年,新药批准上市后总有效专利权期限不超过十四年。
罗颖坤博士认为中国新药补偿制度具体的细节性的规定非常值得期待,比如在中国的新药补偿制度中如何定义新药、如何定义专利权、以及一个专利多于一个新药的情况下如何补偿等等问题,罗颖坤博士看好国内药品市场的发展,也指出接下来会有越来越多的经验和案例,值得从业人员关注。

扫描上方二维码或
点击阅读原文观看本期直播回放
点击阅读原文观看本期直播回放
编辑:肖晋



