
台湾理律事务所朱淑尹:台湾专利链接的介绍与实践

朱淑尹专利师,毕业于中兴大学食品科学系及台湾大学农业化学研究所取得学士及硕士学位,并于2005年取得台湾大学法律学士学位,且通过专利师考试取得专利师证照。另外,也通过了中国专利代理人考试。
朱淑尹专利师专业领域包括生物科技、医药及化学相关发明的专利申请、说明书撰写、专利审查及专利期延长及专利无效等;上述发明领域的专利侵权判定以及专利诉讼中的专利有效性等。
关注“知产前沿”公众号,回复“台湾”获取本期线上直播分享课件。本次直播朱淑尹老师首先介绍了专利链接制度的起源和台湾专利链接制度的立法背景并详细介绍了台湾专利制度的主要内容,随后分别对台湾专利链接制度的登录专利信息、公众检视专利信息、专利声明与停发药证、首家仿制药的销售专属期间四个方面的内容做了详细介绍。
台湾专利链接制度师法美国的药物竞争及专利权回复法案,俗称Hatch-Waxman Act (HWA)。该法案于1984年颁布,颁布之初的目的是为了能够降低药品的价格,鼓励学名药的发展。以美国为例,在法案颁布(1984)之际,仅有20%的药品为学名药,十年后仿制药取代率达到42%,25年后达到66%。
药物竞争及专利权回复法案的内容是逐步从不同的部门法律进行规范,专利链接制度是最后引入台湾的,比如实验免责是2005年在药事法修订的过程中增加的,之后再于专利法中订定。专利链接制度最刚开始是因为要加入 t p p以及台美贸易暨投资架构协议的缘故开始进行相关立法,到2018年1月31日公告药事法修订新增第四章之一西药之专利连结,并于2019年8月20日正式施行。登陆专利信息
台湾地区设有专门的登录(这里的登录与中国大陆的登记同义,下文同)专利信息的系统,该系统用于登录专利或者做专利声明,或者对登录的资讯进行质疑,全部都在这个系统上进行处理。网站地址:https://plls.fda.gov.tw/

新药许可证的所有人可以在上面的网站进行登录,需要特别注意的是新药药品许可证所有人与专利权人不同者,应取得专利权人之同意;该专利权有专属授权且办理登记者,仅需取得专属被授权人之同意。登录时间是药品许可证领取之次日起45日内,但是专利还没有核准的情况之下,就需要专利局核准新药药品许可证后于专利局审定公告之次日起45日内进行登记,另外,修正施行前药品权未消灭者,新药药品许可证所有人需要在专利连接制度施行后三个月内提报专利信息。
台湾的可登陆专利类型也与美国类似,包含物质专利、组合物或配方、医药用途的专利三个方面。分享中,朱淑尹特别提到,在多形态登录的部分,彼时在台湾立法过程中就专利多形体非药品的有效成分,该专利可否登录这一议题进行了激烈的争论,截止现在,专利连结施行办法规定需在查验登记资料中有证明相同疗效的数据的多形态才可登录。
不能登陆的专利的类型包含制程、装置、包装、代谢物中间物。另外,涉及专利的变更和删除时需要在专利信息变更或删除事由发生之次日起45日内提交,一般的变更和删除事由有诸如:专利权期间延长核准公告 ;请求项之更正核准公告 ;专利权撤销确定 ;专利权当然消灭 ;专利权人之姓名或名称、国籍、住所、居所或营业所,代表人变更姓名等等。公众检视专利信息
台湾在法条设计上为了减少或者防止不当登陆的情况出现,所以制定了公众检视信息正确性的程序。任何人发现有已经登载专利信息的发明跟核准的药品无关或者不符合登录专利的规定,甚至登载的专利信息错误以及没有及时办理专利信息变更和删除等情况时,可以以书面形式附带相关证据通知药监局。TFDA(药监局)在接到通知的20天以内,会把相关检视信息转送给新药的药品许可证持有人。新药许可证所有人在收到通知的次日起45日内,应当以书面叙明理由回复TFDA,并视情形办理专利信息之变更或删除。
专利声明与停发药证
专利声明内容
专利声明的内容是指仿制药/生物相似药申请人在提出申请药品许可证时,声明:一、该新药未有任何专利信息之登载 ;二、该新药之专利权已消灭;三、申请人同意该新药之专利权消灭后,中央卫生主管机关才核发药品许可证 ;四、该新药对应之专利权,仿制药/生物相似药申请人主张1.原厂药的专利为无效; 2.未侵害原厂药之专利权。另外在台湾的法律里规定,在某些特殊的情况下不需要做声明,一种情形是药品许可证申请案的申请人跟对照新药药品许可所有人相同,第二种是学名药的申请案经过了新药药品许可专利权人或者专属被授权人的授权之后提出,第三种情形是对照新药的药品许可证已经撤销废止或注销,也就是说其并没有上市,或者曾经上市,但目前已经不在市面销售。所以综合来说,在上述三种情况下,药品许可证申请案的申请人不需要做专利声明。
P4声明与暂停核发许可证
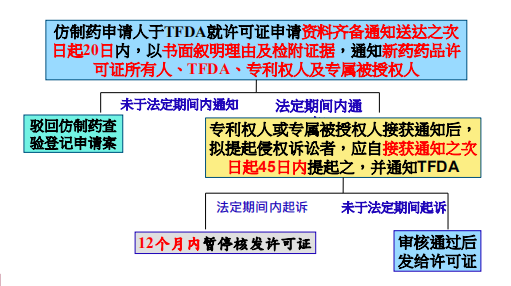
暂停核发许可证的时间是根据各自国家或地区一审诉讼的平均期间来制定的,美国是30个月,台湾是12个月。仿制药/生物相似药申请人于TFDA就许可证申请资料齐备通知送达之次日起20日内,以书面叙明理由及检附证据,通知新药药品许可证所有人、TFDA、专利权人及专属被授权人,如果仿制药申请人没能于法定期间内通知到相关法人,则会被驳回仿制药查验登记申请案。如果仿制药申请人于法定期间内通知到位,专利权人或专属被授权人接获通知后,拟提起侵权诉讼者,应从接到通知的次日起45日内提起诉讼,并通知TFDA。至此,如果专利权人或专属被授权人在法定法定期间内起诉仿制药申请人,则TFDA会在12个月内暂停核发许可证给仿制药申请人,如果专利权人或专属被授权人没有在法定期间起诉仿制药申请人,则TFDA审核通过后颁发仿制药申请人许可证。
朱淑尹老师介绍中特别提到专利链接制度实施后,对于原告(原创药方)的利好是其举证侵权责任降低了,反而是仿制药方在提出申请的时候需要主张原创药方专利无效或原告不构成侵权,所以举证责任转移到了仿制药/生物相似药申请人的身上。
在关于专利声明与停发药证板块分享的后面,朱淑尹老师还详细地介绍了台湾暂停核发许可证的流程以及仿制药查验登记时间和健保核价流程。首家仿制药的销售专属期间
台湾的销专属销售期间跟美国类似,但是台湾的销售专属期间比美国更长,目前法律规定是12个月的销售的专属期间。销售专属期间由首家主张仿制药的申请人获得,这里首家的认定依据是申请数据齐备日最早者。取得销售专属期后,仿制药方可以在领取药品许可证的次日起6个月内进行销售,并自最早销售日的次日起20日内提交实际销售日的证明。关于12个月销售专属期,台湾还规定了第2家递补的情形,如果首家仿制药厂变更声明或者没有在12个月内取得查验登记审查完成的通知时第二家取得销售专属期。另外,如果同一天若有两件以上仿制药查验登记申请案 ,则共同取得12个月的销售专属期间。
值得注意的是,台湾销售专属期间的起算点是起算点以药品之实际销售日为起算日期,销售专属期间由两件以上仿制药查验登记申请案共同取得的,该期间以任一学名药最早的实际销售日为起算日期,终止日期有三种情形,一是自取得药品许可证后6个月内未实际销售药品者,六个月到期后丧失销售专属期权利,二是未于TFDA通知领取药品许可证之期间内领取许可证的,自通知日的最后一天丧失相关权利,三是仿制药厂专利权当然消灭时,销售专属期间的权利也同时丧失。
分享的最后,朱淑尹老师特别提到,台湾专利链接制度实施后,台湾仿制药产业的产值是呈持续上升的趋势,至于有无更多深远的影响还需随着实行时间的推移继续观察。



